Affichage des articles dont le libellé est 2èm Bac. Afficher tous les articles
Affichage des articles dont le libellé est 2èm Bac. Afficher tous les articles
mercredi 24 juillet 2013
 22:50
22:50
 Unknown
Unknown
CLIQUER ICI POUR ACCEDER A L'EPREUVE DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2012 (FILIERE SCIENCE MATHEMATIQUE)-
CLIQUER ICI POUR ACCEDER A LA CORRECTION DE L'EPREUVE DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2012 (FILIERE SCIENCE MATHEMATIQUE)-
voici aussi un exercice très utile concernant l'oxydation de l'ethanol
Oxydation de l'éthanol en acide éthanoïque.
Texte : la législation autorise l'addition de 5 % ( en volume) d'éthanol à l'essence. Va=20 mL de ce carburant sont oxydés par une solution acidifiée de permanganate de potassium C= 0, 4mol/L .Véquivalent = 24 mL. réthanaol = 790 kg m-3. C : 12 ; H : 1 ; O : 16 g/mol
Couples Ox/red : CH3COOH/CH3CH2OH et MnO4-/Mn2+.
Questions traitant de la quantité de matière d'alcool exprimée en mole, en gramme ou en mL.
Analyse :
Il faut écrire les demi-équations électroniques puis l'équation bilan.
5 fois { CH3CH2OH +H2O = 4H+ + 4e- + CH3COOH }
4 fois { MnO4- + 8H+ + 5e- = Mn2+ + 4 H2O }
5 CH3CH2OH + 4 MnO4- + 12H+ = 5 CH3COOH + 4 Mn2+ + 11 H2O .
d'où à l'équivalence : n(alcool) = 5/4 n( MnO4- ) = 1,25 n( MnO4- ).
Une quantité de matière (mol) est égal au volume (L) multipliée par la concentration (mol/L)
n(MnO4-) =C Véquivalent =0,4* 24 10-3 = 9,6 10-3 mol.
n(alcool) = 1,25 * 9,6 10-3 = 0,012 mol ; n(alcool) = 12 mmol.
Une concentration (mol/L) est une quantité de matière (mol) divisée par un volume (L).
[alcool] = n(alcool) / Va = 0,012/0,020 = 12/20 ; [alcool] = 0,6 mol/L.
Masse (g) d'alcool dans 1 L = quantité de matière (mol) * masse molaire (g/mol)
M = 12*2+6+16 = 46 g/mol ; m(alcool) = 0,6*46 = 27,6 g dans 1 L.
volume ( mL) = masse ( g) divisée par la masse volumique ( g/mL).
790 kg m-3 = 790 *103 / 106 g/cm3 = 0,79 g/cm3 = 0,79 g/mL.
1 mL a une masse de 0,79 g
V mL ont une masse de 27,6 g
d'où le volume d'alcool : 27,6 / 0,79 = 35 mL dans 1 L de carburant
pourcentage volumique : 35/1000 *100 = 3,5 %.
a) exact : après l'équivalence l'ion permanganate de couleur violette est en excès.
Seules les affirmations contenant l'une des informations suivantes sont donc exactes :
BONNE PREPARATION ET BONNE CHANCE
 22:47
22:47
 Unknown
Unknown
CLIQUER ICI POUR ACCEDER A L'EPREUVE DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2012 (FILIERE SCIENCE PHYSIQUE)
CLIQUER ICI POUR ACCEDER A LA CORRECTION DE L'EPREUVE DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2012 (FILIERE SCIENCE PHYSIQUE)
exercice expliquant le pile daniel(très important)
Texte : Zn/Zn2+(aq)//Cu2+(aq)/Cu.
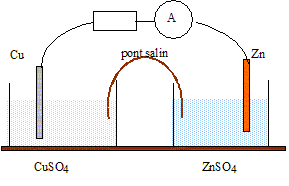
Volume de chaque solution : V= 0,05 L ( 50 mL) ; concentration de chaque solution : C = 0,010 mol/L. Masse de chaque électrode : 3 g
Masse atomique molaire : Zn : 65,4 ; Cu : 63,5 g/mol.
Analyse :
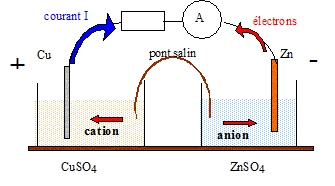
Questions traitant du sens de circulation des porteurs de charges.
Electrons dans les conducteurs métalliques et ions dans les solutions et le pont salin.
Le zinc, métal plus réducteur que le cuivre, s'oxyde : Zn = Zn2+ +2e-.
Questions traitant des mots " anode, cathode, oxydation, réduction".
Le zinc, métal plus réducteur que le cuivre, s'oxyde : Zn = Zn2+ +2e-.
Le zinc subit une oxydation ; le zinc constitue l'anode négative.
Les ions Cu2+ se réduisent : Cu2+ +2e- = Cu.
Les ions cuivre (II) subissent une réduction ; le cuivre constitue la cathode positive.
n(Cu2+) =n(Zn2+) =VC = 0,05*0,01 = 5 10-4 mol masse (g) / masse molaire (g/mol) pour le métal des électrodes. n(Cu) = 3/63,5 = 4,72 10-2 mol ; n(Zn) = 3/65,4 = 4,59 10-2 mol ; si Zns est en défaut : 4,6 10-2 -xmax = 0 soit xmax = 4,6 10-2 mol Question traitant de " la pile est usée ". Une pile est usée si le quotient de réaction est égal à la constante d'équilibre de la réaction se produisant dans la pile. Le réactif limitant a presque entierement disparu. Les affirmations contenant l'une des informations ci-dessus sont donc exactes. |
BONNE PREPARATION ET BONNE CHANCE
 22:29
22:29
 Unknown
Unknown
CLIQUER ICI POUR ACCEDER A L'EPREUVE DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2013 (FILIERE SCIENCE PHYSIQUE)
CLIQUER ICI POUR ACCEDER AU CORRIGE DE L'EPREUVE(par MR SBIRO) DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2013 (FILIERE SCIENCE PHYSIQUE)
Etude théorique du dosage.
Donner l'expression de la concentration molaire CA de l'acide éthanoïque dans la solution diluée en fonction de CB, VBE et VA, VA est le volume prélevé de la solution d'acide éthanoïque à doser.
CH3COOH aq + HO-aq = CH3COO-aq + H2O.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
CA VA = CB VBE.
Donner l'expression de la concentration C'A de l'acide éthanoïque contenu dans le vinaigre en fonction de CA.
La solution mère a été diluée 10 fois : C'A = 10 CA.
Donner l'expression de la concentration C'A en fonction de la masse d'acide éthanoïque mA, de la masse molaire moléculaire de l'acide éthanoïque M(CH3COOH) et du volume V de la solution.
n = mA / M(CH3COOH) ; C'A = n / V = mA / ( M(CH3COOH) V).
mA = C'A V M(CH3COOH).
Quelle est la masse m à considérer pour définir le degré du vinaigre.
Le degré d'un vinaigre est égal à la masse d'acide acétique pour V =100 mL = 0,1 L de vinaigre mesurés à la température de 20°C.
m = C'A *0,1* M(CH3COOH).
Donner l'expression du degré d'acidité d en fonction de VBE.
C'A = 10 CB VBE / VA ; d = CB VBE / VA M(CH3COOH).
M(CH3COOH) = 60,0 g/mol ; masse volumique de l'acide éthanoïque r = 1,02 103 g/L ; VA = 20 mL.
A cette solution placée dans le becher ont été ajoutés 100 mL d'eau distillée pour réaliser le dosage conductimétrique ; ainsi,on considèrera par la suite que le volume total Vtot de solution dans le becher est constant.
BONNE PREPARATION ET BONNE CHANCE
 22:18
22:18
 Unknown
Unknown
CLIQUER ICI POUR ACCEDER A L'EPREUVE DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2013 (FILIERE SCIENCE MATHEMATIQUE)
CLIQUER ICI POUR ACCEDER AU CORRIGE DE L'EPREUVE(PAR MR SBIRO) DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2013 (FILIERE SCIENCE MATHEMATIQUE)
Donner les noms des corps suivants : NH3 ;
NH4Cl ; CH3-COOH ; CH3 COONa ; Ca(OH)2 ;
KCl
solutions :
NH3 : ammoniaque, basique
NH4Cl : chlorure d'ammonium ( NH4+ :
acide faible donc pH inférieur à 7)
CH3-COOH : acide éthanoïque , solution
acide
CH3 COONa : éthanoate de sodium ( ion
éthanoate : base faible donc pH supérieur à 7)
Ca(OH)2 : hydroxyde de calcium, base
KCl : chlorure de potassium, solution neutre
le BBT est jaune en milieu acide, vert en milieu neutre et bleu en milieu basique.
le BBT est jaune en milieu acide, vert en milieu neutre et bleu en milieu basique.
L'eau de chaux contient les ions hydroxydes HO- et
Ca2+ :
en présence de gaz carbonique il se forme un trouble
de carbonate de calcium CaCO3.
Inscription à :
Articles
(
Atom
)




.jpg)






